常见的4种氨氮废水处理方法!
2021-06-24 来自: 山东环科环保科技有限公司 浏览次数:985
水体中的氮元素作为造成富营养化和发黑发臭的元凶之一,往往是污水处理工作中的重点关注对象,其重要性甚至不亚于有机污染物。如果你遇到氮浓度丧心病狂的工业废水时,那么生物脱氮往往喜提下岗,物化脱氮这个迷人的小可爱就要闪亮登场了。
氨氮的危害
在时代高速发展的今天,氨氮可谓是日益猖狂,肆虐无数。成为危害生态环境以及人类健康的一大要素!它们广泛存在于市政污水和工业废水中。主要有以下危害:
①富营养化
氮磷是藻类生长的必要营养元素,当水体中的氮含量超过0.2 mg/L,磷含量超过0.02 mg/L,水体就会营养化而导致藻类过量生长,发生在海洋称为“赤潮”,发生在内湖称为“水华”。当藻类过量生长并死亡,将消耗水体中的溶解氧,使水质恶化,鱼虾死亡。某些藻类还含有毒素,在贝类等软体动物体内富集,人若食用将导致严重的中毒反应,甚至死亡。
②水体发黑发臭
在硝化菌的作用下,1mg氨氮完全氧化成硝态氮需消耗4.57mg溶解氧,当水体中的氨氮过多时,将导致水体呈缺氧状态,鱼类难以生存,从而发黑发臭,降低观赏和利用价值。
常见的物化脱氮技术
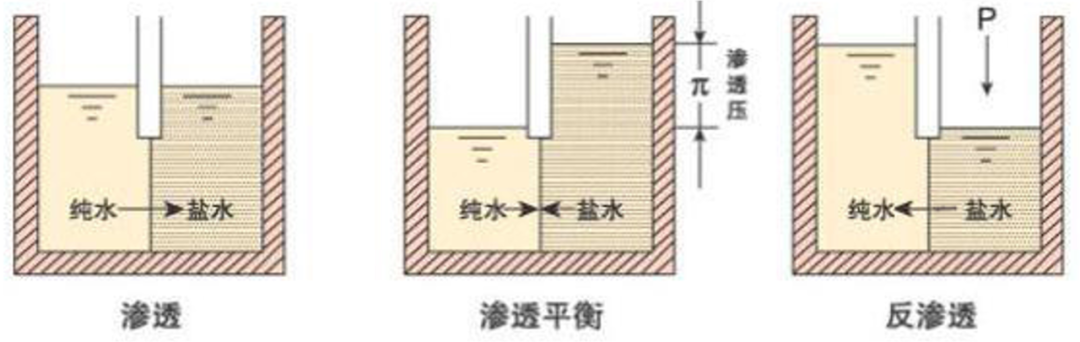
1. 反渗透法/RO
对膜一侧的料液施加压力,当压力超过它的渗透压时,溶剂会逆着自然渗透的方向作反向渗透,从而在膜的低压侧得到透过的溶剂,即渗透液;高压侧得到浓缩的溶液,即浓缩液。
2. 折点氯化法
在中性条件下,次氯酸钠或氯1气把氨态氮氧化成氮气,从水体中逸散。其反应机理如下(以次氯酸钠为例)
NaClO + H2O —→ HClO + NaOH
NH3 + HClO —→ NH2Cl + H2O
NH2Cl + HClO —→ NHCl2 + H2O
NHCl2 + H2O —→ NOH + 2Cl- + 2H+
NHCl2 + NOH —→ N2↑ + HClO + H+ + Cl-
总反应方程式为:
2NH3 + 2NaClO —→ N2↑ + 3H2O + 3NaCl
3. 鸟粪石法/MAP
鸟粪石是磷酸铵镁的俗称,化学式为MgNH4PO4·6H2O,是由一些鸟类在海岛上排泄的粪便聚积风干后类似石头而得名,其溶度积常数为2.5×10-13,在碱性条件下容易形成沉淀。
MAP法去除氨氮的化学反应方程式:
Mg2++NH4++PO43-+6H2O—→MgNH4PO4·6H2O↓(pKsp=12.6)
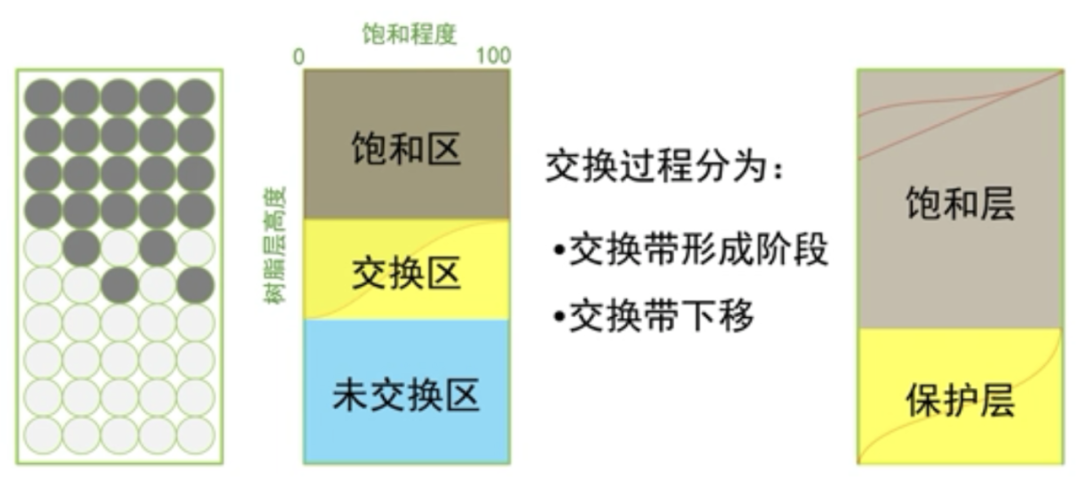
4.离子交换法
利用离子间的浓度差和交换剂上的功能基对离子的亲和力作为推动力达到吸附铵离子的目的。离子交换的过程是可逆的,当交换剂达到吸附饱和后,通过投加特 定的解析剂,可使交换剂上吸附的离子解析,一方面实现了交换剂再生利用,另一方面可得到高浓度的解析液。
物化脱氮技术应用案例
NH3-N含量分别为30000mg/L、3000mg/L、300mg/L、30mg/L的废水各应选用什么处理方法?
(1) NH3-N为30000mg/L:相当于3%含量的氨溶液,具有回收价值,由于铵盐的溶解度随温度变化很大,可以采用蒸发冷凝结晶的方法回收铵盐。
(2) NH3-N为3000mg/L:若直接蒸发,耗能太高,不够经济,可采用加碱吹脱的方法回收氨水,或采用鸟粪石法回收磷酸铵镁,或采用离子交换法回收铵盐。
(3) NH3-N为300mg/L:已无回收价值,考虑生物法和化学法,由于传统的硝化反硝化法需要消耗大量碳源,可考虑短程硝化反硝化法、厌氧氨氧化法,或采用折点氯化法。
(4) NH3-N为30mg/L:生活污水的氨氮就在这个范围,考虑经济传统的硝化反硝化法。
由于污水性质上的差异,物化脱氮技术各有优势与不足,要针对不同性质的污水,对其成分进行分析,然后选择一种或几种方法联合的方式进行处理,才能达到理想的处理效果。
技术装备